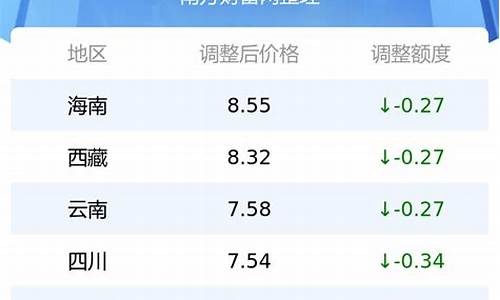
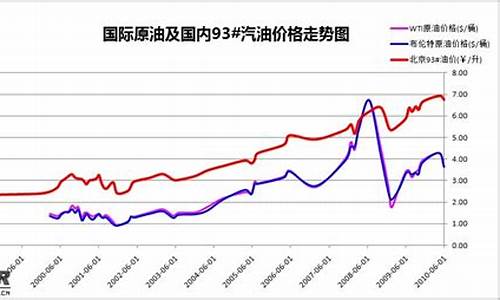
2009180重油价格_2021年重油价格
1.什么食物可以代表你的城市?
2.济南哪里经营医用氧气,医用氧气瓶?
3.非成品油石油制品柴油算不算变票

[编辑本段]一、氧气的性质(oxygen )
概述:
中文名:氧气
1.物理性质
①性状:色,味,态:无色无味气体(标准状况)
②熔点:-218.4℃(变为蓝色雪花状的固体) 沸点:-182.9℃(变为淡蓝色液体)
③密度:1.429克/升(气),1.419克/厘米3(液),1.426克/厘米3(固)
④水溶性:不易溶于水,标准情况下,1L水中可以溶解约30mL的氧气
⑤贮存:天蓝色钢瓶
2.化学性质
总体来说,氧气的化学性质比较活泼。
(1)、氧气跟金属反应:
与钾的反应:
4K+O2=2K2O,钾的表面变暗
2K+O2=K2O2;K+O2=KO2(超氧化钾),(条件:点燃或加热,两个反应同时进行)
与钠的反应:
4Na+O2=2Na2O,钠的表面变暗
2Na+O2=Na2O2(条件:点燃或加热),产生**火焰,放出大量的热,生成淡**粉末。
与镁的反应;2Mg+O2=2MgO(条件:点燃),剧烈燃烧发出耀眼的强光,放出大量热,生成白色固体。
与铝的反应;4Al+3O2=2Al2O3(条件:点燃),发出明亮的光,放出热量,生成白色固体。
与铁的反应;
4Fe+3O2+2xH2O=2Fe2O3·H2O,(铁锈的形成)
3Fe+2O2=Fe3O4(条件:点燃),红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。
与锌的反应:2Zn+O2=2ZnO(条件:点燃),
与铜的反应;2Cu+O2=2CuO(条件:加热),加热后亮红色的铜丝表面生成一层黑色物质。
(2)、氧气跟非金属反应:
与氢气的反应:2H2+O2=2H2O(条件:点燃),产生淡蓝色火焰,放出大量的热,并有水生成。
与碳的反应:CO2(carbon dioxide)
(碳+氧气→二氧化碳)C+O2=CO2(条件:点燃),剧烈燃烧,发出白光,放出热量,生成使石灰水变浑浊的气体。
氧气不完全时则产生一氧化碳:2C+O2=2CO(条件:点燃)。
与硫的反应:S+O2=SO2(条件:点燃),发生明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体,该气体也能使成清石灰水变浑浊,且能使酸性高锰酸钾溶液或品红溶液褪色。
与红磷的反应:4P+5O2=P4O10(条件:点燃),剧烈燃烧,发光放热,生成白烟。(P4O10为五氧化二磷的分子式,此处写P2O5亦可)
与白磷的反应:P4+5O2=P4O10,白磷在空气中自燃,发光发热,生成白烟。
与氮气的反应:N2+O2=2NO(条件:放电)
与氧气的反应:3O2=2O3(条件:放电)
(3)、氧气跟一些有机物反应,如甲烷、乙炔、酒精、石蜡等能在氧气中燃烧生成水和二氧化碳。
气态烃类的燃烧通常发出明亮的蓝色火焰,放出大量的热,生成水和能使澄清石灰水变浑浊的气体。
甲烷:CH4+2O2→CO2+2H2O(条件:点燃)
乙烯:C2H4+3O2→2CO2+2H2O(条件:点燃)
乙炔:2C2H2+5O2→4CO2+2H2O(条件:点燃)
苯:2C6H6+15O2→12CO2+6H2O(条件:点燃)
甲醇:2CH3OH+3O2→2CO2+4H2O(条件:点燃)
乙醇:CH3CH2OH+3O2→2CO2+3H2O(条件:点燃)
碳氢氧化合物与氧气发生燃烧的通式:4CxHyOz+(4x+y-2z)O2→4xCO2+2yH2O(条件:点燃)(通式完成后应注意化简!下同)
烃的燃烧通式:4CxHy+(4x+y)O2→4xCO2+2yH2O(条件:点燃)
乙醇被氧气氧化:2CH3CH2OH+O2→2CH3CHO+2H2O(条件:Cu,加热)
此反应包含两个步骤:(1)2Cu+O2=2CuO(加热)(2)CH3CH2OH+CuO→CH3CHO+Cu+H2O(加热)
氯仿与氧气的反应:2CHCl3+O2→2COCl2(光气)+2HCl
(4)、氧气与其它化合物的反应:
硫化氢的燃烧:(完全)2H2S+3O2=2H2O+2SO2;(不完全)2H2S+O2=2H2O+2S(条件:点燃)
煅烧黄铁矿:4FeS2+11O2=2Fe2O3+8SO2(条件:高温)
二氧化硫的催化氧化:2SO2+O2=2SO3(条件:V2O5,加热)
空气中硫酸酸雨的形成:2SO2+O2+2H2O=2H2SO4
氨气在纯氧中的燃烧:4NH3+3O2(纯)=2N2+6H2O (条件:点燃)
氨气的催化氧化:4NH3+5O2=4NO+6H2O (条件:Pt,加热)
一氧化氮与氧气的反应:2NO+O2=2NO2
二、氧气的某些用途和负作用
1.冶炼工艺
在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。在有色金属冶炼中,用富氧也可以缩短冶炼时间提高产量。
2.化学工业
在生产合成氨时,氧气主要用于原料气的氧化,例如,重油的高温裂化,以及煤粉的气化等,以强化工艺过程,提高化肥产量。
3.国防工业
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧。
4.医疗保健方面
供给呼吸:用于缺氧、低氧或无
氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
一.氧是心脏的“动力源”
氧是人体进行新陈代谢的关键物质,是人体生命活动的第一需要。呼吸的氧转化为人体内可利用的氧,称为血氧。血液携带血氧向全身输入能源,血氧的输送量与心脏、大脑的工作状态密切相关。心脏泵血能力越强,血氧的含量就越高;心脏冠状动脉的输血能力越强,血氧输送到心脑及全身的浓度就越高,人体重要器官的运行状态就越好。
二.氧气喷泉
随着人们对新鲜氧气的需求愿望与日俱增,在美国洛杉矶等大城市,一种氧气喷泉吧随之设立。在氧气喷泉吧里,人们手持透明氧气罐,其上插上了精巧的外接吸收装置,轻轻一吸,罐内的纯氧即喷涌而出。带着柠檬或其他香味的氧气可连续输送20分钟。除此之外,美国其他与氧有关的产品不断涌现,如各种含氧水、含氧汽水、含氧胶丸等。新兴的氧气消费,已形成一股新潮流。
三.增加吸氧量可减少术后感染及止吐
美国的《新英格兰医学杂志》发表一项新的研究成果。奥地利、美国及澳大利亚的医师报告,只要在手术中和手术后给病人增加吸氧量,病人术后感染危险将降低一半。因为增氧可以提高免疫系统的免疫能力,可为患者的“免疫大军”提供更多“”,杀死伤口部位的细菌。
这项研究是在奥地利维也纳和德国汉堡医院的500名患者身上进行的。其过程是:在整个手术期间和术后两个小时,为第一组250名患者实施含30%氧的,另一组250名患者在同一时间内接受含80%氧的。结果第一组手术后有28人感染,而第二组手术后只有13人感染。
病人在术后发生恶心或呕吐颇为常见,病人感到非常难受。进行此项研究的师说,增加吸氧比至2009年为止所使用的所有止吐药效果更为明显,且无危险和价格低廉。氧气防止呕吐的机制可能是防止肠道局部缺血,从而阻止催吐因子的释放。但完全用氧而不用一氧化氮是不可取的,因为这有可能使病人在手术中觉醒。
四.高压氧治疗突发性耳聋
据某医院高压氧科主任介绍,高压氧不仅能改善内耳听觉器官的缺氧状态,而且还能改善内耳血液循环即组织代谢,促进听觉功能的恢复。一旦患了突发性耳聋,应立即去医院高压氧科,因为高压氧对突发性耳聋的疗效常取决于最初的治疗时间,一般在发病后三天之内(最迟不应超过一周)治疗效果最佳。
五.高压氧治疗牙周病效果好
牙周病指的是牙龈、牙周膜和牙槽骨的炎症、变形、萎缩,最后导致牙齿松动、脱落的一种慢性进行性疾病。患了牙周病会有牙龈充血、红肿、出血,牙龈沟加深,形成了牙周炎,牙周袋溢脓,有口臭,牙齿松动,并常伴有牙龈退缩。
牙周病的常规治疗效果并不理想。近年来,医务工作者用高压氧治疗牙周病,取得了良好的疗效。高压氧治疗牙周病可提高牙周病局部组织的氧含量和氧的弥散距离,促进侧枝循环的重建,改善局部循环。血管收缩效应可缓解局部肿胀。另外,高压氧还能有效地抑制细菌,尤其是厌氧菌的生长繁殖,改善牙周组织的供血、供氧,促进新陈代谢,以利于局部组织的修复,达到抗炎、消肿、止血和除臭的目的。
六、中老年需要补氧
缺氧一般分为两种:一种是体外缺氧,一种是体内缺氧:
体外缺氧:主要是因为外部原因造成的缺氧。人处在一个缺少氧气的环境里,如阴天气压低,高原地区,环境污染地区以及写字楼、商场、地下室等都容易造成体外缺氧。
体内缺氧:是指人体自身的原因,导致吸入氧气的不足,与一些老年病、工作节奏快等原因有关。如呼吸系统疾病(气管炎、哮喘、肺气肿、肺心病、肺部感染等);血液循环不好(各种心脏疾病,脑供血不足、脑梗、脉管炎、静脉曲张等)。长期处于体内缺氧状态,人体各个组织供氧不足,加速了身体的衰竭,甚至引发中风等意外,直接威胁到生命的安全。
中老年缺氧的症状表现
1) 轻度缺氧:常常打哈欠,手脚冰凉,在大商场、地下设施内感到胸闷气短,心慌、喘气急促。
2) 中度缺氧:爬楼梯两层以上胸闷气短、喘气急促;口臭、胃酸过多、便秘、皮肤干燥、睡眠不足、多梦易醒,注意力不集中,脸色苍白,心情紧张后头屑增多,出虚汗、视力下降,血压、血脂、血糖偏高,抵抗力减弱,易患感冒。
七.过度吸氧的负作用
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。人如果在大于0.05 MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各胀器缺氧而发生损害。在0.1 MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。人在0.2 MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时 ~ 2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。如加入0.3 MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
[编辑本段]三、氧气的制造
一般实验室制造氧气使用的方法是:
实验装置
1.加热高锰酸钾,化学式为:2KMnO4===(△)K2MnO4+MnO2+O2↑
2.用催化剂MnO2并加热氯酸钾,化学式为:2KClO3===(△,MnO2) 2KCl+3O2↑
3.双氧水(过氧化氢)在催化剂MnO2(或红砖粉末,土豆,水泥等)中,生成O2和H2O,化学式为: 2H2O2===(MnO2) 2H2O+O2↑
工业制造氧气方法:
1. 压缩冷却空气
2.分子筛
核潜艇中制氧气的方法:2Na2O2+2CO2===2Na2CO3+O2↑ 此方法的优点:1、常温下进行 2、使氧气和二氧化碳形成循环(人消耗氧气,呼出二氧化碳,而此反应消耗二氧化碳,生成氧气)
[编辑本段]四、氧气的发现
世界上最早发现氧气的是我国唐朝的炼丹家马和。马和认真地观察各种可燃物,如木炭、硫磺等在空气中燃烧的情况后,提出的结论是:空气成分复杂,主要由阳气(氮气)和阴气(氧气)组成,其中阳气比阴气多得多,阴气可以与可燃物化合把它从空气中除去,而阳气仍可安然无恙地留在空气中。马和进一步指出,阴气存在于青石(氧化物)、火硝(硝酸盐)等物质中。如用火来加热它们,朋气就会放出来,他还认为水中也有大量阴气,不过常难把它取出来。马和的发现比欧洲早1000年。
马和把毕生研究的成果记录在一本名叫《平龙认》的书中,该书68页,出版日期是唐至德元年(756年)3月9日,一直流传到清代,后被德国侵略者乘乱抢走。
1774年英国化学家J.普里斯特利里和他的同伴用一个大凸透镜将太阳光聚焦后加热,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表 ,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡 ,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。
[编辑本段]五、 测定空气中氧气体积分数
名称:红磷燃烧实验
原理:红磷在密闭容器中燃烧测定空气中氧气的体积分数
红磷+氧气=(点燃)五氧化二磷
4P+5O2=(点燃)2P2O5
方程式:4P+5O2=点燃=2P2O5
现象:红磷:**火焰 白烟 放出热量
水沿导管进入集气瓶中至约五分之一处停止
结论:1.氧气约占空气体积的五分之一(原理)(1.氧气难溶于水 2.氮气不可燃不助燃)
注意:红磷可用其他物质代替,但生成物必须不为气体,且只与氧气反应
成功关键:气密性良好 否则结果偏小
红磷量要足 否则结果偏小
等到装置完全冷却再打开止水夹 否则结果偏小
实验开始前加上止水夹 否则结果偏大
[编辑本段]六、氧元素
一种化学元素。化学符号O ,原子序数8 ,原子量15.9994,属周期系ⅥA族。 )
氧的发现 1774年英国化学家J.普里斯特利里和他的同伴用一个大凸透镜将太阳光聚焦后加热,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表 ,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡 ,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。
氧的存在 氧有三种稳定同位素,即氧16、氧17和氧18,其中氧 16 含量占 99.759 % 。氧在地壳中的含量为 48.6%,居首位,氧在地球上分布极广,大气中的氧占20.95%,海洋和江河湖泊中到处都是氧的化合物水,氧在水中占88.8%。地球上还存在着许多含氧酸盐,如土壤中所含的铝硅酸盐,还有硅酸盐、氧化物、碳酸盐的矿物。大气中的氧不断地用于动物的新陈代谢,人体中氧占65%,植物的光合作用能把二氧化碳转变为氧气,使氧得以不断地循环。虽然地球上到处是氧,但氧主要是从空气中提取的,有取之不尽的。
氧是化学性质活泼的元素 ,除了惰性气体,卤素中的氯、溴、碘以及一些不活泼的金属(如金 、铂 )之外 ,绝大多 数非 金属和金 属 都能直接与 氧化合,但氧可以通过间接的方法与惰性气体氙生成氧化物:
XeF6 + 3H2O=XeO3 + 6HF
同样,氯的氧化物也可以通过间接的方法制得:
2Cl2+2HgO=HgO?HgCl2+Cl2O
在常温下,氧还可以将其他化合物氧化:
2NO+O2=2NO2
氧可以将葡萄糖氧化,这一作用是构成生物体呼吸作用的主要反应:
C6H12O6+6O2=6CO2+6H2O
氧的氧化态为 -2 、- 1、+ 2 。 氧的氧化性仅次于氟 ,因此,氧和氟发生反应时,表现为+2价,形成氟化氧(F2O)。氧与金属元素形成的二元化合物有氧化物、过氧化物、超氧化物。氧分子可以失去一个电子,生成二氧基正离子(),形成O2PtF6等化合物。
氧气的实验室制法有:①氯酸钾的热分解:
②电解水:
③氧化物热分解:
④以二氧化锰做催化剂,使过氧化氢分解:
⑤高锰酸钾的热分解
在宇宙飞船中 ,可利用宇航员 呼出的二氧化碳气体与超氧化钾作用,产生氧气,供宇航员呼吸用。
生产和应用 大规模生产氧气的方法是分馏液态空气 ,首先将空气压缩,待其膨氧胀后又冷冻为液态空气,由于稀有气体和氮气的沸点都比氧气低,经过分馏,剩下的便是液氧,可贮存在高压钢瓶中。所有的氧化反应和燃烧过程都需要氧,例如炼钢时除硫、磷等杂质,氧和乙炔混合气燃烧时温度高达3500℃,用于钢铁的焊接和切割。玻璃制造、水泥生产、矿物焙烧、烃类加工都需要氧。液氧还用作火箭燃料,它比其他燃料更便宜。在低氧或缺氧的环境中工作的人,如潜水员、宇航员,氧更是维持生命所不可缺少的。但氧的活性状态如 、OH以及H2O2等对生物的组织有严重的损坏作用,紫外线对皮肤和眼的损害多与此种作用有关。是空气的组分之一,无色、无嗅、无味。氧气密度比空气大,在标准状况(0℃和大气压强101325帕)下密度为1.429克/升,能溶于水,但溶解度很小,1L水中约溶30mL氧气。在压强为101kPa时,氧气在约-180摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
1.氧气能与很多元素直接化合,生成氧化物。
2.氧气是燃烧和动植物呼吸所必需的气体,富氧空气用于医疗和高空飞行,纯氧用于炼钢和切割、焊接金属,液氧用做火箭发动机的氧化剂。
3.生产上应用的氧气由液态空气分馏而得。
4.一个氧分子是由两个氧原子组成的 原子半径0.074纳米
5.物质与氧发生的化学反应属于氧化反应(combination reaction)
什么食物可以代表你的城市?
[编辑本段]一、氧气的性质(oxygen )
概述:
中文名:氧气
1.物理性质
①性状:色,味,态:无色无味气体(标准状况)
②熔点:-218.4℃(变为蓝色雪花状的固体) 沸点:-182.9℃(变为淡蓝色液体)
③密度:1.429克/升(气),1.419克/厘米3(液),1.426克/厘米3(固)
④水溶性:不易溶于水,标准情况下,1L水中可以溶解约30mL的氧气
⑤贮存:天蓝色钢瓶
2.化学性质
总体来说,氧气的化学性质比较活泼。
(1)、氧气跟金属反应:
与钾的反应:
4K+O2=2K2O,钾的表面变暗
2K+O2=K2O2;K+O2=KO2(超氧化钾),(条件:点燃或加热,两个反应同时进行)
与钠的反应:
4Na+O2=2Na2O,钠的表面变暗
2Na+O2=Na2O2(条件:点燃或加热),产生**火焰,放出大量的热,生成淡**粉末。
与镁的反应;2Mg+O2=2MgO(条件:点燃),剧烈燃烧发出耀眼的强光,放出大量热,生成白色固体。
与铝的反应;4Al+3O2=2Al2O3(条件:点燃),发出明亮的光,放出热量,生成白色固体。
与铁的反应;
4Fe+3O2+2xH2O=2Fe2O3·H2O,(铁锈的形成)
3Fe+2O2=Fe3O4(条件:点燃),红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。
与锌的反应:2Zn+O2=2ZnO(条件:点燃),
与铜的反应;2Cu+O2=2CuO(条件:加热),加热后亮红色的铜丝表面生成一层黑色物质。
(2)、氧气跟非金属反应:
与氢气的反应:2H2+O2=2H2O(条件:点燃),产生淡蓝色火焰,放出大量的热,并有水生成。
与碳的反应:CO2(carbon dioxide)
(碳+氧气→二氧化碳)C+O2=CO2(条件:点燃),剧烈燃烧,发出白光,放出热量,生成使石灰水变浑浊的气体。
氧气不完全时则产生一氧化碳:2C+O2=2CO(条件:点燃)。
与硫的反应:S+O2=SO2(条件:点燃),发生明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体,该气体也能使成清石灰水变浑浊,且能使酸性高锰酸钾溶液或品红溶液褪色。
与红磷的反应:4P+5O2=P4O10(条件:点燃),剧烈燃烧,发光放热,生成白烟。(P4O10为五氧化二磷的分子式,此处写P2O5亦可)
与白磷的反应:P4+5O2=P4O10,白磷在空气中自燃,发光发热,生成白烟。
与氮气的反应:N2+O2=2NO(条件:放电)
与氧气的反应:3O2=2O3(条件:放电)
(3)、氧气跟一些有机物反应,如甲烷、乙炔、酒精、石蜡等能在氧气中燃烧生成水和二氧化碳。
气态烃类的燃烧通常发出明亮的蓝色火焰,放出大量的热,生成水和能使澄清石灰水变浑浊的气体。
甲烷:CH4+2O2→CO2+2H2O(条件:点燃)
乙烯:C2H4+3O2→2CO2+2H2O(条件:点燃)
乙炔:2C2H2+5O2→4CO2+2H2O(条件:点燃)
苯:2C6H6+15O2→12CO2+6H2O(条件:点燃)
甲醇:2CH3OH+3O2→2CO2+4H2O(条件:点燃)
乙醇:CH3CH2OH+3O2→2CO2+3H2O(条件:点燃)
碳氢氧化合物与氧气发生燃烧的通式:4CxHyOz+(4x+y-2z)O2→4xCO2+2yH2O(条件:点燃)(通式完成后应注意化简!下同)
烃的燃烧通式:4CxHy+(4x+y)O2→4xCO2+2yH2O(条件:点燃)
乙醇被氧气氧化:2CH3CH2OH+O2→2CH3CHO+2H2O(条件:Cu,加热)
此反应包含两个步骤:(1)2Cu+O2=2CuO(加热)(2)CH3CH2OH+CuO→CH3CHO+Cu+H2O(加热)
氯仿与氧气的反应:2CHCl3+O2→2COCl2(光气)+2HCl
(4)、氧气与其它化合物的反应:
硫化氢的燃烧:(完全)2H2S+3O2=2H2O+2SO2;(不完全)2H2S+O2=2H2O+2S(条件:点燃)
煅烧黄铁矿:4FeS2+11O2=2Fe2O3+8SO2(条件:高温)
二氧化硫的催化氧化:2SO2+O2=2SO3(条件:V2O5,加热)
空气中硫酸酸雨的形成:2SO2+O2+2H2O=2H2SO4
氨气在纯氧中的燃烧:4NH3+3O2(纯)=2N2+6H2O (条件:点燃)
氨气的催化氧化:4NH3+5O2=4NO+6H2O (条件:Pt,加热)
一氧化氮与氧气的反应:2NO+O2=2NO2
二、氧气的某些用途和负作用
1.冶炼工艺
在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。在有色金属冶炼中,用富氧也可以缩短冶炼时间提高产量。
2.化学工业
在生产合成氨时,氧气主要用于原料气的氧化,例如,重油的高温裂化,以及煤粉的气化等,以强化工艺过程,提高化肥产量。
3.国防工业
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧。
4.医疗保健方面
供给呼吸:用于缺氧、低氧或无
氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
一.氧是心脏的“动力源”
氧是人体进行新陈代谢的关键物质,是人体生命活动的第一需要。呼吸的氧转化为人体内可利用的氧,称为血氧。血液携带血氧向全身输入能源,血氧的输送量与心脏、大脑的工作状态密切相关。心脏泵血能力越强,血氧的含量就越高;心脏冠状动脉的输血能力越强,血氧输送到心脑及全身的浓度就越高,人体重要器官的运行状态就越好。
二.氧气喷泉
随着人们对新鲜氧气的需求愿望与日俱增,在美国洛杉矶等大城市,一种氧气喷泉吧随之设立。在氧气喷泉吧里,人们手持透明氧气罐,其上插上了精巧的外接吸收装置,轻轻一吸,罐内的纯氧即喷涌而出。带着柠檬或其他香味的氧气可连续输送20分钟。除此之外,美国其他与氧有关的产品不断涌现,如各种含氧水、含氧汽水、含氧胶丸等。新兴的氧气消费,已形成一股新潮流。
三.增加吸氧量可减少术后感染及止吐
美国的《新英格兰医学杂志》发表一项新的研究成果。奥地利、美国及澳大利亚的医师报告,只要在手术中和手术后给病人增加吸氧量,病人术后感染危险将降低一半。因为增氧可以提高免疫系统的免疫能力,可为患者的“免疫大军”提供更多“”,杀死伤口部位的细菌。
这项研究是在奥地利维也纳和德国汉堡医院的500名患者身上进行的。其过程是:在整个手术期间和术后两个小时,为第一组250名患者实施含30%氧的,另一组250名患者在同一时间内接受含80%氧的。结果第一组手术后有28人感染,而第二组手术后只有13人感染。
病人在术后发生恶心或呕吐颇为常见,病人感到非常难受。进行此项研究的师说,增加吸氧比至2009年为止所使用的所有止吐药效果更为明显,且无危险和价格低廉。氧气防止呕吐的机制可能是防止肠道局部缺血,从而阻止催吐因子的释放。但完全用氧而不用一氧化氮是不可取的,因为这有可能使病人在手术中觉醒。
四.高压氧治疗突发性耳聋
据某医院高压氧科主任介绍,高压氧不仅能改善内耳听觉器官的缺氧状态,而且还能改善内耳血液循环即组织代谢,促进听觉功能的恢复。一旦患了突发性耳聋,应立即去医院高压氧科,因为高压氧对突发性耳聋的疗效常取决于最初的治疗时间,一般在发病后三天之内(最迟不应超过一周)治疗效果最佳。
五.高压氧治疗牙周病效果好
牙周病指的是牙龈、牙周膜和牙槽骨的炎症、变形、萎缩,最后导致牙齿松动、脱落的一种慢性进行性疾病。患了牙周病会有牙龈充血、红肿、出血,牙龈沟加深,形成了牙周炎,牙周袋溢脓,有口臭,牙齿松动,并常伴有牙龈退缩。
牙周病的常规治疗效果并不理想。近年来,医务工作者用高压氧治疗牙周病,取得了良好的疗效。高压氧治疗牙周病可提高牙周病局部组织的氧含量和氧的弥散距离,促进侧枝循环的重建,改善局部循环。血管收缩效应可缓解局部肿胀。另外,高压氧还能有效地抑制细菌,尤其是厌氧菌的生长繁殖,改善牙周组织的供血、供氧,促进新陈代谢,以利于局部组织的修复,达到抗炎、消肿、止血和除臭的目的。
六、中老年需要补氧
缺氧一般分为两种:一种是体外缺氧,一种是体内缺氧:
体外缺氧:主要是因为外部原因造成的缺氧。人处在一个缺少氧气的环境里,如阴天气压低,高原地区,环境污染地区以及写字楼、商场、地下室等都容易造成体外缺氧。
体内缺氧:是指人体自身的原因,导致吸入氧气的不足,与一些老年病、工作节奏快等原因有关。如呼吸系统疾病(气管炎、哮喘、肺气肿、肺心病、肺部感染等);血液循环不好(各种心脏疾病,脑供血不足、脑梗、脉管炎、静脉曲张等)。长期处于体内缺氧状态,人体各个组织供氧不足,加速了身体的衰竭,甚至引发中风等意外,直接威胁到生命的安全。
中老年缺氧的症状表现
1) 轻度缺氧:常常打哈欠,手脚冰凉,在大商场、地下设施内感到胸闷气短,心慌、喘气急促。
2) 中度缺氧:爬楼梯两层以上胸闷气短、喘气急促;口臭、胃酸过多、便秘、皮肤干燥、睡眠不足、多梦易醒,注意力不集中,脸色苍白,心情紧张后头屑增多,出虚汗、视力下降,血压、血脂、血糖偏高,抵抗力减弱,易患感冒。
七.过度吸氧的负作用
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。人如果在大于0.05 MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各胀器缺氧而发生损害。在0.1 MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。人在0.2 MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时 ~ 2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。如加入0.3 MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
[编辑本段]三、氧气的制造
一般实验室制造氧气使用的方法是:
实验装置
1.加热高锰酸钾,化学式为:2KMnO4===(△)K2MnO4+MnO2+O2↑
2.用催化剂MnO2并加热氯酸钾,化学式为:2KClO3===(△,MnO2) 2KCl+3O2↑
3.双氧水(过氧化氢)在催化剂MnO2(或红砖粉末,土豆,水泥等)中,生成O2和H2O,化学式为: 2H2O2===(MnO2) 2H2O+O2↑
工业制造氧气方法:
1. 压缩冷却空气
2.分子筛
核潜艇中制氧气的方法:2Na2O2+2CO2===2Na2CO3+O2↑ 此方法的优点:1、常温下进行 2、使氧气和二氧化碳形成循环(人消耗氧气,呼出二氧化碳,而此反应消耗二氧化碳,生成氧气)
[编辑本段]四、氧气的发现
世界上最早发现氧气的是我国唐朝的炼丹家马和。马和认真地观察各种可燃物,如木炭、硫磺等在空气中燃烧的情况后,提出的结论是:空气成分复杂,主要由阳气(氮气)和阴气(氧气)组成,其中阳气比阴气多得多,阴气可以与可燃物化合把它从空气中除去,而阳气仍可安然无恙地留在空气中。马和进一步指出,阴气存在于青石(氧化物)、火硝(硝酸盐)等物质中。如用火来加热它们,朋气就会放出来,他还认为水中也有大量阴气,不过常难把它取出来。马和的发现比欧洲早1000年。
马和把毕生研究的成果记录在一本名叫《平龙认》的书中,该书68页,出版日期是唐至德元年(756年)3月9日,一直流传到清代,后被德国侵略者乘乱抢走。
1774年英国化学家J.普里斯特利里和他的同伴用一个大凸透镜将太阳光聚焦后加热,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表 ,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡 ,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。
[编辑本段]五、 测定空气中氧气体积分数
名称:红磷燃烧实验
原理:红磷在密闭容器中燃烧测定空气中氧气的体积分数
红磷+氧气=(点燃)五氧化二磷
4P+5O2=(点燃)2P2O5
方程式:4P+5O2=点燃=2P2O5
现象:红磷:**火焰 白烟 放出热量
水沿导管进入集气瓶中至约五分之一处停止
结论:1.氧气约占空气体积的五分之一(原理)(1.氧气难溶于水 2.氮气不可燃不助燃)
注意:红磷可用其他物质代替,但生成物必须不为气体,且只与氧气反应
成功关键:气密性良好 否则结果偏小
红磷量要足 否则结果偏小
等到装置完全冷却再打开止水夹 否则结果偏小
实验开始前加上止水夹 否则结果偏大
[编辑本段]六、氧元素
一种化学元素。化学符号O ,原子序数8 ,原子量15.9994,属周期系ⅥA族。 )
氧的发现 1774年英国化学家J.普里斯特利里和他的同伴用一个大凸透镜将太阳光聚焦后加热,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表 ,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡 ,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。
氧的存在 氧有三种稳定同位素,即氧16、氧17和氧18,其中氧 16 含量占 99.759 % 。氧在地壳中的含量为 48.6%,居首位,氧在地球上分布极广,大气中的氧占20.95%,海洋和江河湖泊中到处都是氧的化合物水,氧在水中占88.8%。地球上还存在着许多含氧酸盐,如土壤中所含的铝硅酸盐,还有硅酸盐、氧化物、碳酸盐的矿物。大气中的氧不断地用于动物的新陈代谢,人体中氧占65%,植物的光合作用能把二氧化碳转变为氧气,使氧得以不断地循环。虽然地球上到处是氧,但氧主要是从空气中提取的,有取之不尽的。
氧是化学性质活泼的元素 ,除了惰性气体,卤素中的氯、溴、碘以及一些不活泼的金属(如金 、铂 )之外 ,绝大多 数非 金属和金 属 都能直接与 氧化合,但氧可以通过间接的方法与惰性气体氙生成氧化物:
XeF6 + 3H2O=XeO3 + 6HF
同样,氯的氧化物也可以通过间接的方法制得:
2Cl2+2HgO=HgO?HgCl2+Cl2O
在常温下,氧还可以将其他化合物氧化:
2NO+O2=2NO2
氧可以将葡萄糖氧化,这一作用是构成生物体呼吸作用的主要反应:
C6H12O6+6O2=6CO2+6H2O
氧的氧化态为 -2 、- 1、+ 2 。 氧的氧化性仅次于氟 ,因此,氧和氟发生反应时,表现为+2价,形成氟化氧(F2O)。氧与金属元素形成的二元化合物有氧化物、过氧化物、超氧化物。氧分子可以失去一个电子,生成二氧基正离子(),形成O2PtF6等化合物。
氧气的实验室制法有:①氯酸钾的热分解:
②电解水:
③氧化物热分解:
④以二氧化锰做催化剂,使过氧化氢分解:
⑤高锰酸钾的热分解
在宇宙飞船中 ,可利用宇航员 呼出的二氧化碳气体与超氧化钾作用,产生氧气,供宇航员呼吸用。
生产和应用 大规模生产氧气的方法是分馏液态空气 ,首先将空气压缩,待其膨氧胀后又冷冻为液态空气,由于稀有气体和氮气的沸点都比氧气低,经过分馏,剩下的便是液氧,可贮存在高压钢瓶中。所有的氧化反应和燃烧过程都需要氧,例如炼钢时除硫、磷等杂质,氧和乙炔混合气燃烧时温度高达3500℃,用于钢铁的焊接和切割。玻璃制造、水泥生产、矿物焙烧、烃类加工都需要氧。液氧还用作火箭燃料,它比其他燃料更便宜。在低氧或缺氧的环境中工作的人,如潜水员、宇航员,氧更是维持生命所不可缺少的。但氧的活性状态如 、OH以及H2O2等对生物的组织有严重的损坏作用,紫外线对皮肤和眼的损害多与此种作用有关。是空气的组分之一,无色、无嗅、无味。氧气密度比空气大,在标准状况(0℃和大气压强101325帕)下密度为1.429克/升,能溶于水,但溶解度很小,1L水中约溶30mL氧气。在压强为101kPa时,氧气在约-180摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
1.氧气能与很多元素直接化合,生成氧化物。
2.氧气是燃烧和动植物呼吸所必需的气体,富氧空气用于医疗和高空飞行,纯氧用于炼钢和切割、焊接金属,液氧用做火箭发动机的氧化剂。
3.生产上应用的氧气由液态空气分馏而得。
4.一个氧分子是由两个氧原子组成的 原子半径0.074纳米
5.物质与氧发生的化学反应属于氧化反应(combination reaction)
济南哪里经营医用氧气,医用氧气瓶?
说到美食,我们国家的美食绝对当仁不让。 你会发现,即使是一个小小的县城,也有自己的特色美食,因此,可以说中国的美食是遍布全国各地的,接下来,我就来给大家细数我们国家因美食而出名的城市,有机会一定要去观光品尝哦。?
国内8座城市,8种代表美食,你了解多少? 你吃过多少种? 都吃过才算吃货! 我都吃过!?
一、成都的红糖糍粑
要说中国的美食之都,成都说第二,没有人敢称第一,成都的美食之都的美名名扬海内外,很多外国人来中国都会到成都逛吃一圈,更有直接因为美食而定居在当地的外国人。曾经看到网上介绍过一位外国友人,初来成都时扬言要半年吃遍全中国,结果半年后记者再次访,发现半年过去了,这位友人连成都都还有没吃过来!这也是在网络上引得众网友调侃不已。成都的美食几乎都与辣味有关,比如火锅、串串、担担面等,可以说是无辣不欢。其实除了辣,当地的甜品也很不错,比如红糖糍粑,软软糯糯的口感,甜而不腻的味道,非常受广大食客欢迎。
二、重庆的火锅
重庆的口味也是辣,重庆火锅真的是让人欲罢不能。除了有名的秦妈等店铺,其实随便在街边找一家火锅店都非常美味。去年底去重庆玩了一圈,吃的我简直不想回家,那里的辣太合我的口味了,是那种柔柔的辣,一点都不辣嗓子,吃下去更不会有胃部灼烧的感觉。油碟也很神奇,明明是火辣辣的火锅食材,在油碟里蘸一蘸,就一点不显得辣了,而且味道让人着迷。除了火锅,还有小面,记得当时几乎天天早上去吃,加一个鸡蛋,太美味了。
三、长沙的臭豆腐
长沙也是美食众多的城市,供人们逛吃的小街就有无数条,比如黄兴路等,去长沙旅游的人都会去这些步行街好好地逛一逛吃一吃。在当地,最为人们所熟知的要数当地的臭豆腐。一块块豆腐在油锅里炸的起泡,讲究的是外表酥脆和内里不改鲜嫩,浇上汤汁,十分美味。除了臭豆腐,还有长沙才有的一家名叫“茶颜悦色”的饮品店,里面的饮品制作的十分正宗,每天都排着长长的队伍,推荐大家去品尝一下。
四、厦门的沙茶面
厦门是最近几年兴起的旅游城市,鼓浪屿、日光岩,还有当地独特的地域风情,为厦门带去了大量的游客。而去到厦门的游客,怎么能少得了品尝当地的美食呢?土笋冻、沙茶面……厦门的美食让人眼花缭乱。而当地的素饼,更是买来作为礼物的首选。
五、西安的油泼面
西安是北方城市,喜爱面食,因此来西安一定要品尝当地的面食,特别是油泼面,裤带面、臊子面、肉夹馍、泡馍等等,去年我在西安住了一个星期,那些面食都没有吃过来。在当地,游客最多的要数回民街还有永兴坊,里面沿街都是吃的还有各种特色物品,十分适合逛吃。
六、广州的早茶
广州人对早饭十分讲究,早茶店很多,都需要提前预约,点一份早茶,一边吃一边翻报纸,十分惬意。
七、南京的鸭肉
有人细说鸭子到了南京就再也走不出来了,南京最有名的要数各种鸭子,桂花鸭、盐水鸭、鸭血粉丝汤,都是不容错过的美食。
八、武汉的热干面
提到武汉就不得不提到热干面,这是当地最为有名的美食,除此之外,还有很多美食,散落在不起眼的地方。
对于这8座城市8种美食代表,不知道大家都熟悉了吗?如果你是一个吃货,那么何不借着机会,带上家人,一起到这些城市走一走,品尝一下这里的美食呢?相信你一定会喜欢上的哦!
非成品油石油制品柴油算不算变票
[编辑本段]一、氧气的性质(oxygen )
概述:
中文名:氧气
1.物理性质
①性状:色,味,态:无色无味气体(标准状况)
②熔点:-218.4℃(变为蓝色雪花状的固体) 沸点:-182.9℃(变为淡蓝色液体)
③密度:1.429克/升(气),1.419克/厘米3(液),1.426克/厘米3(固)
④水溶性:不易溶于水,标准情况下,1L水中可以溶解约30mL的氧气
⑤贮存:天蓝色钢瓶
2.化学性质
总体来说,氧气的化学性质比较活泼。
(1)、氧气跟金属反应:
与钾的反应:
4K+O2=2K2O,钾的表面变暗
2K+O2=K2O2;K+O2=KO2(超氧化钾),(条件:点燃或加热,两个反应同时进行)
与钠的反应:
4Na+O2=2Na2O,钠的表面变暗
2Na+O2=Na2O2(条件:点燃或加热),产生**火焰,放出大量的热,生成淡**粉末。
与镁的反应;2Mg+O2=2MgO(条件:点燃),剧烈燃烧发出耀眼的强光,放出大量热,生成白色固体。
与铝的反应;4Al+3O2=2Al2O3(条件:点燃),发出明亮的光,放出热量,生成白色固体。
与铁的反应;
4Fe+3O2+2xH2O=2Fe2O3·H2O,(铁锈的形成)
3Fe+2O2=Fe3O4(条件:点燃),红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。
与锌的反应:2Zn+O2=2ZnO(条件:点燃),
与铜的反应;2Cu+O2=2CuO(条件:加热),加热后亮红色的铜丝表面生成一层黑色物质。
(2)、氧气跟非金属反应:
与氢气的反应:2H2+O2=2H2O(条件:点燃),产生淡蓝色火焰,放出大量的热,并有水生成。
与碳的反应:CO2(carbon dioxide)
(碳+氧气→二氧化碳)C+O2=CO2(条件:点燃),剧烈燃烧,发出白光,放出热量,生成使石灰水变浑浊的气体。
氧气不完全时则产生一氧化碳:2C+O2=2CO(条件:点燃)。
与硫的反应:S+O2=SO2(条件:点燃),发生明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体,该气体也能使成清石灰水变浑浊,且能使酸性高锰酸钾溶液或品红溶液褪色。
与红磷的反应:4P+5O2=P4O10(条件:点燃),剧烈燃烧,发光放热,生成白烟。(P4O10为五氧化二磷的分子式,此处写P2O5亦可)
与白磷的反应:P4+5O2=P4O10,白磷在空气中自燃,发光发热,生成白烟。
与氮气的反应:N2+O2=2NO(条件:放电)
与氧气的反应:3O2=2O3(条件:放电)
(3)、氧气跟一些有机物反应,如甲烷、乙炔、酒精、石蜡等能在氧气中燃烧生成水和二氧化碳。
气态烃类的燃烧通常发出明亮的蓝色火焰,放出大量的热,生成水和能使澄清石灰水变浑浊的气体。
甲烷:CH4+2O2→CO2+2H2O(条件:点燃)
乙烯:C2H4+3O2→2CO2+2H2O(条件:点燃)
乙炔:2C2H2+5O2→4CO2+2H2O(条件:点燃)
苯:2C6H6+15O2→12CO2+6H2O(条件:点燃)
甲醇:2CH3OH+3O2→2CO2+4H2O(条件:点燃)
乙醇:CH3CH2OH+3O2→2CO2+3H2O(条件:点燃)
碳氢氧化合物与氧气发生燃烧的通式:4CxHyOz+(4x+y-2z)O2→4xCO2+2yH2O(条件:点燃)(通式完成后应注意化简!下同)
烃的燃烧通式:4CxHy+(4x+y)O2→4xCO2+2yH2O(条件:点燃)
乙醇被氧气氧化:2CH3CH2OH+O2→2CH3CHO+2H2O(条件:Cu,加热)
此反应包含两个步骤:(1)2Cu+O2=2CuO(加热)(2)CH3CH2OH+CuO→CH3CHO+Cu+H2O(加热)
氯仿与氧气的反应:2CHCl3+O2→2COCl2(光气)+2HCl
(4)、氧气与其它化合物的反应:
硫化氢的燃烧:(完全)2H2S+3O2=2H2O+2SO2;(不完全)2H2S+O2=2H2O+2S(条件:点燃)
煅烧黄铁矿:4FeS2+11O2=2Fe2O3+8SO2(条件:高温)
二氧化硫的催化氧化:2SO2+O2=2SO3(条件:V2O5,加热)
空气中硫酸酸雨的形成:2SO2+O2+2H2O=2H2SO4
氨气在纯氧中的燃烧:4NH3+3O2(纯)=2N2+6H2O (条件:点燃)
氨气的催化氧化:4NH3+5O2=4NO+6H2O (条件:Pt,加热)
一氧化氮与氧气的反应:2NO+O2=2NO2
二、氧气的某些用途和负作用
1.冶炼工艺
在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。在有色金属冶炼中,用富氧也可以缩短冶炼时间提高产量。
2.化学工业
在生产合成氨时,氧气主要用于原料气的氧化,例如,重油的高温裂化,以及煤粉的气化等,以强化工艺过程,提高化肥产量。
3.国防工业
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧。
4.医疗保健方面
供给呼吸:用于缺氧、低氧或无
氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
一.氧是心脏的“动力源”
氧是人体进行新陈代谢的关键物质,是人体生命活动的第一需要。呼吸的氧转化为人体内可利用的氧,称为血氧。血液携带血氧向全身输入能源,血氧的输送量与心脏、大脑的工作状态密切相关。心脏泵血能力越强,血氧的含量就越高;心脏冠状动脉的输血能力越强,血氧输送到心脑及全身的浓度就越高,人体重要器官的运行状态就越好。
二.氧气喷泉
随着人们对新鲜氧气的需求愿望与日俱增,在美国洛杉矶等大城市,一种氧气喷泉吧随之设立。在氧气喷泉吧里,人们手持透明氧气罐,其上插上了精巧的外接吸收装置,轻轻一吸,罐内的纯氧即喷涌而出。带着柠檬或其他香味的氧气可连续输送20分钟。除此之外,美国其他与氧有关的产品不断涌现,如各种含氧水、含氧汽水、含氧胶丸等。新兴的氧气消费,已形成一股新潮流。
三.增加吸氧量可减少术后感染及止吐
美国的《新英格兰医学杂志》发表一项新的研究成果。奥地利、美国及澳大利亚的医师报告,只要在手术中和手术后给病人增加吸氧量,病人术后感染危险将降低一半。因为增氧可以提高免疫系统的免疫能力,可为患者的“免疫大军”提供更多“”,杀死伤口部位的细菌。
这项研究是在奥地利维也纳和德国汉堡医院的500名患者身上进行的。其过程是:在整个手术期间和术后两个小时,为第一组250名患者实施含30%氧的,另一组250名患者在同一时间内接受含80%氧的。结果第一组手术后有28人感染,而第二组手术后只有13人感染。
病人在术后发生恶心或呕吐颇为常见,病人感到非常难受。进行此项研究的师说,增加吸氧比至2009年为止所使用的所有止吐药效果更为明显,且无危险和价格低廉。氧气防止呕吐的机制可能是防止肠道局部缺血,从而阻止催吐因子的释放。但完全用氧而不用一氧化氮是不可取的,因为这有可能使病人在手术中觉醒。
四.高压氧治疗突发性耳聋
据某医院高压氧科主任介绍,高压氧不仅能改善内耳听觉器官的缺氧状态,而且还能改善内耳血液循环即组织代谢,促进听觉功能的恢复。一旦患了突发性耳聋,应立即去医院高压氧科,因为高压氧对突发性耳聋的疗效常取决于最初的治疗时间,一般在发病后三天之内(最迟不应超过一周)治疗效果最佳。
五.高压氧治疗牙周病效果好
牙周病指的是牙龈、牙周膜和牙槽骨的炎症、变形、萎缩,最后导致牙齿松动、脱落的一种慢性进行性疾病。患了牙周病会有牙龈充血、红肿、出血,牙龈沟加深,形成了牙周炎,牙周袋溢脓,有口臭,牙齿松动,并常伴有牙龈退缩。
牙周病的常规治疗效果并不理想。近年来,医务工作者用高压氧治疗牙周病,取得了良好的疗效。高压氧治疗牙周病可提高牙周病局部组织的氧含量和氧的弥散距离,促进侧枝循环的重建,改善局部循环。血管收缩效应可缓解局部肿胀。另外,高压氧还能有效地抑制细菌,尤其是厌氧菌的生长繁殖,改善牙周组织的供血、供氧,促进新陈代谢,以利于局部组织的修复,达到抗炎、消肿、止血和除臭的目的。
六、中老年需要补氧
缺氧一般分为两种:一种是体外缺氧,一种是体内缺氧:
体外缺氧:主要是因为外部原因造成的缺氧。人处在一个缺少氧气的环境里,如阴天气压低,高原地区,环境污染地区以及写字楼、商场、地下室等都容易造成体外缺氧。
体内缺氧:是指人体自身的原因,导致吸入氧气的不足,与一些老年病、工作节奏快等原因有关。如呼吸系统疾病(气管炎、哮喘、肺气肿、肺心病、肺部感染等);血液循环不好(各种心脏疾病,脑供血不足、脑梗、脉管炎、静脉曲张等)。长期处于体内缺氧状态,人体各个组织供氧不足,加速了身体的衰竭,甚至引发中风等意外,直接威胁到生命的安全。
中老年缺氧的症状表现
1) 轻度缺氧:常常打哈欠,手脚冰凉,在大商场、地下设施内感到胸闷气短,心慌、喘气急促。
2) 中度缺氧:爬楼梯两层以上胸闷气短、喘气急促;口臭、胃酸过多、便秘、皮肤干燥、睡眠不足、多梦易醒,注意力不集中,脸色苍白,心情紧张后头屑增多,出虚汗、视力下降,血压、血脂、血糖偏高,抵抗力减弱,易患感冒。
七.过度吸氧的负作用
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。人如果在大于0.05 MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各胀器缺氧而发生损害。在0.1 MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。人在0.2 MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时 ~ 2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。如加入0.3 MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
[编辑本段]三、氧气的制造
一般实验室制造氧气使用的方法是:
实验装置
1.加热高锰酸钾,化学式为:2KMnO4===(△)K2MnO4+MnO2+O2↑
2.用催化剂MnO2并加热氯酸钾,化学式为:2KClO3===(△,MnO2) 2KCl+3O2↑
3.双氧水(过氧化氢)在催化剂MnO2(或红砖粉末,土豆,水泥等)中,生成O2和H2O,化学式为: 2H2O2===(MnO2) 2H2O+O2↑
工业制造氧气方法:
1. 压缩冷却空气
2.分子筛
核潜艇中制氧气的方法:2Na2O2+2CO2===2Na2CO3+O2↑ 此方法的优点:1、常温下进行 2、使氧气和二氧化碳形成循环(人消耗氧气,呼出二氧化碳,而此反应消耗二氧化碳,生成氧气)
[编辑本段]四、氧气的发现
世界上最早发现氧气的是我国唐朝的炼丹家马和。马和认真地观察各种可燃物,如木炭、硫磺等在空气中燃烧的情况后,提出的结论是:空气成分复杂,主要由阳气(氮气)和阴气(氧气)组成,其中阳气比阴气多得多,阴气可以与可燃物化合把它从空气中除去,而阳气仍可安然无恙地留在空气中。马和进一步指出,阴气存在于青石(氧化物)、火硝(硝酸盐)等物质中。如用火来加热它们,朋气就会放出来,他还认为水中也有大量阴气,不过常难把它取出来。马和的发现比欧洲早1000年。
马和把毕生研究的成果记录在一本名叫《平龙认》的书中,该书68页,出版日期是唐至德元年(756年)3月9日,一直流传到清代,后被德国侵略者乘乱抢走。
1774年英国化学家J.普里斯特利里和他的同伴用一个大凸透镜将太阳光聚焦后加热,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表 ,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡 ,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。
[编辑本段]五、 测定空气中氧气体积分数
名称:红磷燃烧实验
原理:红磷在密闭容器中燃烧测定空气中氧气的体积分数
红磷+氧气=(点燃)五氧化二磷
4P+5O2=(点燃)2P2O5
方程式:4P+5O2=点燃=2P2O5
现象:红磷:**火焰 白烟 放出热量
水沿导管进入集气瓶中至约五分之一处停止
结论:1.氧气约占空气体积的五分之一(原理)(1.氧气难溶于水 2.氮气不可燃不助燃)
注意:红磷可用其他物质代替,但生成物必须不为气体,且只与氧气反应
成功关键:气密性良好 否则结果偏小
红磷量要足 否则结果偏小
等到装置完全冷却再打开止水夹 否则结果偏小
实验开始前加上止水夹 否则结果偏大
[编辑本段]六、氧元素
一种化学元素。化学符号O ,原子序数8 ,原子量15.9994,属周期系ⅥA族。 )
氧的发现 1774年英国化学家J.普里斯特利里和他的同伴用一个大凸透镜将太阳光聚焦后加热,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表 ,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡 ,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。
氧的存在 氧有三种稳定同位素,即氧16、氧17和氧18,其中氧 16 含量占 99.759 % 。氧在地壳中的含量为 48.6%,居首位,氧在地球上分布极广,大气中的氧占20.95%,海洋和江河湖泊中到处都是氧的化合物水,氧在水中占88.8%。地球上还存在着许多含氧酸盐,如土壤中所含的铝硅酸盐,还有硅酸盐、氧化物、碳酸盐的矿物。大气中的氧不断地用于动物的新陈代谢,人体中氧占65%,植物的光合作用能把二氧化碳转变为氧气,使氧得以不断地循环。虽然地球上到处是氧,但氧主要是从空气中提取的,有取之不尽的。
氧是化学性质活泼的元素 ,除了惰性气体,卤素中的氯、溴、碘以及一些不活泼的金属(如金 、铂 )之外 ,绝大多 数非 金属和金 属 都能直接与 氧化合,但氧可以通过间接的方法与惰性气体氙生成氧化物:
XeF6 + 3H2O=XeO3 + 6HF
同样,氯的氧化物也可以通过间接的方法制得:
2Cl2+2HgO=HgO?HgCl2+Cl2O
在常温下,氧还可以将其他化合物氧化:
2NO+O2=2NO2
氧可以将葡萄糖氧化,这一作用是构成生物体呼吸作用的主要反应:
C6H12O6+6O2=6CO2+6H2O
氧的氧化态为 -2 、- 1、+ 2 。 氧的氧化性仅次于氟 ,因此,氧和氟发生反应时,表现为+2价,形成氟化氧(F2O)。氧与金属元素形成的二元化合物有氧化物、过氧化物、超氧化物。氧分子可以失去一个电子,生成二氧基正离子(),形成O2PtF6等化合物。
氧气的实验室制法有:①氯酸钾的热分解:
②电解水:
③氧化物热分解:
④以二氧化锰做催化剂,使过氧化氢分解:
⑤高锰酸钾的热分解
在宇宙飞船中 ,可利用宇航员 呼出的二氧化碳气体与超氧化钾作用,产生氧气,供宇航员呼吸用。
生产和应用 大规模生产氧气的方法是分馏液态空气 ,首先将空气压缩,待其膨氧胀后又冷冻为液态空气,由于稀有气体和氮气的沸点都比氧气低,经过分馏,剩下的便是液氧,可贮存在高压钢瓶中。所有的氧化反应和燃烧过程都需要氧,例如炼钢时除硫、磷等杂质,氧和乙炔混合气燃烧时温度高达3500℃,用于钢铁的焊接和切割。玻璃制造、水泥生产、矿物焙烧、烃类加工都需要氧。液氧还用作火箭燃料,它比其他燃料更便宜。在低氧或缺氧的环境中工作的人,如潜水员、宇航员,氧更是维持生命所不可缺少的。但氧的活性状态如 、OH以及H2O2等对生物的组织有严重的损坏作用,紫外线对皮肤和眼的损害多与此种作用有关。是空气的组分之一,无色、无嗅、无味。氧气密度比空气大,在标准状况(0℃和大气压强101325帕)下密度为1.429克/升,能溶于水,但溶解度很小,1L水中约溶30mL氧气。在压强为101kPa时,氧气在约-180摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
1.氧气能与很多元素直接化合,生成氧化物。
2.氧气是燃烧和动植物呼吸所必需的气体,富氧空气用于医疗和高空飞行,纯氧用于炼钢和切割、焊接金属,液氧用做火箭发动机的氧化剂。
3.生产上应用的氧气由液态空气分馏而得。
4.一个氧分子是由两个氧原子组成的 原子半径0.074纳米
5.物质与氧发生的化学反应属于氧化反应(combination reaction)
一、油品消费税征收范围是怎样的
1、汽油
汽油是指用原油或其他原料加工生产的辛烷值不小于66的可用作汽油发动机燃料的各种轻质油。含铅汽油是指铅含量每升超过0.013克的汽油。汽油分为车用汽油和航空汽油。以汽油、汽油组分调和生产的甲醇汽油、乙醇汽油也属于本税目征收范围。
2、柴油
柴油是指用原油或其他原料加工生产的倾点或凝点在-50至30的可用作柴油发动机燃料的各种轻质油和以柴油组分为主、经调和精制可用作柴油发动机燃料的非标油。 以柴油、柴油组分调和生产的生物柴油也属于本税目征收范围。
3、石脑油
石脑油又叫化工轻油,是以原油或其他原料加工生产的用于化工原料的轻质油。石脑油的征收范围包括除汽油、柴油、**煤油、溶剂油以外的各种轻质油。非标汽油、重整生成油、拔头油、戊烷原料油、轻裂解料(减压柴油VGO和常压柴油O)重裂解料、加氢裂化尾油、芳烃抽余油均属轻质油,属于石脑油征收范围。
4、溶剂油
溶剂油是用原油或其他原料加工生产的用于涂料、油漆、食用油、印刷油墨、皮革、农药、橡胶、化妆品生产和机械清洗、胶粘行业的轻质油。橡胶填充油、溶剂油原料,属于溶剂油征收范围。
5、**煤油
**煤油也叫喷气燃料,是用原油或其他原料加工生产的用作喷气发动机和喷气推进系统燃料的各种轻质油。
6、润滑油
润滑油是用原油或其他原料加工生产的用于内燃机、机械加工过程的润滑产品。润滑油分为矿物性润滑油、植物性润滑油、动物性润滑油和化工原料合成润滑油。润滑油的征收范围包括矿物性润滑油、矿物性润滑油基础油、植物性润滑油、动物性润滑油和化工原料合成润滑油。以植物性、动物性和矿物性基础油(或矿物性润滑油)混合掺配而成的“混合性”润滑油,不论矿物性基础油(或矿物性润滑油)所占比例高低,均属润滑油的征收范围。
7、燃料油
燃料油也称重油、渣油,是用原油或其他原料加工生产,主要用作电厂发电、锅炉用燃料、加热炉燃料、冶金和其他工业炉燃料。蜡油、船用重油、常压重油、减压重油、180CTS燃料油、7号燃料油、糠醛油、工业燃料、4-6号燃料油等油品的主要用途是作为燃料燃烧,属于燃料油征收范围。
二、香烟征收消费税的范围
凡是以烟叶为原料加工生产的产品,不论使用何种辅料,均属于本税目的征收范围。本税目下设甲类卷烟、乙类卷烟、雪茄烟、烟丝四个子目。
卷烟是指将各种烟叶切成烟丝,按照配方要求均匀混合,加入糖、酒、香料等辅料,用白色盘纸、棕色盘纸、涂布纸或烟草薄片经机器或手工卷制的普通卷烟和雪茄型卷烟。
(一)甲类卷烟
甲类卷烟是指每标准条(200支,下同)调拨价格在70元(不含增值税)以上(含70元)的卷烟,其从价税率为56%。根据《国家税务总局关于调整烟产品消费税政策的通知》(财税[2009]84号)。
(二)乙类卷烟
乙类卷烟是指每标准条(200支,下同)调拨价格在70元(不含增值税)以下的卷烟,其从价税率为36%。根据《国家税务总局关于调整烟产品消费税政策的通知》( 财税[2009]84号)。
(三)雪茄烟
雪茄烟是指以晾晒烟为原料或者以晾晒烟和烤烟为原料,用烟叶或卷烟纸、烟草薄片作为烟支内*皮,再用烟叶作为烟支外包皮,经机器或手工卷制而成的烟草制品。按内*皮所用材料的不同可分为全叶卷雪茄烟和半叶卷雪茄烟。
雪茄烟的征收范围包括各种规格、型号的雪茄烟。其从价定额税率为36%。
(四)烟丝
烟丝是指将烟叶切成丝状、粒状、片状、末状或其他形状,再加入辅料,经过发酵、储存,不经卷制即可供销售吸用的烟草制品。
烟丝的征收范围包括以烟叶为原料加工生产的不经卷制的散装烟,如斗烟、莫合烟、烟末、水烟、黄红烟丝等等。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。